質譜解析
質譜解析是指從質譜中識別出化學式、碎片裂解特徵、以及其他可能的碎片離子的分析方法[1][2]。質譜圖繪製的是質荷比與其對應的相對豐度的關係。電子游離質譜法常用於有機化合物的鑑定[3][4]。有機化學家會將化合物的質譜作為解析化合物結構的一部分;質譜的解譜也是許多有機化學課程的一部分。
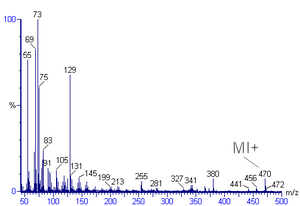
質譜生成[編輯]

電子游離(EI)是常用的一類質譜離子源,採用的是一束電子與氣相分子M相互作用形成離子:
表示分子離子[5],上標「+」表示離子電荷,上標「•」表示自由基離子的未成對電子。電子束採用的能量通常為70電子伏特。游離過程一般會引起分子化學鍵的大量斷裂。
游離室的高真空環境致使分子的平均自由程從10厘米到1公里不等,因此裂解可被視為單分子過程。裂解剛開始時,電子先從最低游離能的位置被激發。由於電子能量的順序是非成鍵電子 > π 鍵電子 > σ 鍵電子,所以被游離的順序也是非成鍵電子 > π 鍵電子 > σ 鍵電子。 [6]

質譜圖中豐度最高的峰稱為基峰,對應的通常是分子離子(並非絕對)。對於分子離子的確定可能會是一件較為困難的事情。對於有機化合物,分子離子峰的相對豐度隨著分支以及同系物中質量的增加而降低。例如,甲苯的分子離子峰位於 92 m/z 處(對應其分子量)。分子離子峰之前也常常會伴隨著一個M-1或M-2峰,分別對應於氫自由基或二氫的丟失。這裡的M是指化合物的分子量。在甲苯的譜圖中,氫自由基(質子-電子對)丟失,形成的是M-1 (91)峰。
分子的裂解也會形成質量小於分子離子的峰。裂解有許多反應途徑,但只有新形成的陽離子(而非自由基碎片或中性碎片)會出現在質譜圖中。亞穩態峰(metastable peak)是指位於非整數質量處的豐度較低而展寬的峰。這些峰來自於壽命較短的離子;這些離子的平均壽命短於該離子穿過游離室到達檢測器所需的時間。
分子式測定[編輯]
氮規則[編輯]
氮規則規定,對於含有氫、碳、氮、氧、矽、磷、硫或鹵素的有機分子,如果氮原子數為奇數,則標稱質量(nominal mass)為奇數;如果氮原子數為偶數,則標稱質量為偶數[7][8]。適用於氮規則的結構要求分子中的原子的共價鍵的數量(將每個σ鍵和π鍵計算為單獨的共價鍵)等於其標準價數。
環規則[編輯]
從不飽和度原理得出,僅含碳、氫、鹵素、氮和氧的分子遵循以下公式
其中 C 是碳原子數,H 是氫原子數,X 是鹵素原子數,N 是氮原子數。
偶電子規則[編輯]
偶電子規則指出,具有偶數電子(陽離子但不是自由基離子)的離子傾向於形成偶電子碎片離子,而奇電子離子(自由基離子)則形成奇電子離子或偶電子離子[9]。偶電子組分(even-electron species)傾向於分裂成另一個偶電子陽離子和一個中性分子,而不是兩個奇電子組分:
OE +• →EE + + R •, OE +• →OE +• + N
史蒂文森規則[編輯]
產物陽離子越穩定,相應的分解過程就越豐富。可用幾種理論來預測裂解過程,例如電子八隅體規則(octet rule)、共振穩定(resonance stabilization)和超共軛(hyperconjugation)等。 [6]
13規則[編輯]
通過13規則中的簡單幾步,可列出給定分子量可能的化學式[10]。第一步是假設分子中僅存在碳和氫,並且該分子包含一定數量的CH「單元(unit)」,每個單元的標稱質量為13。如果所討論的分子的分子量為M,可能的CH單元數為n,那麼有
其中r是餘數。分子的基本公式可寫為
不飽和度為
u若為負值,表示分子中存在雜原子;若為半整數,則表示分子中存在奇數個氮原子。在添加雜原子時,分子式可以用等價質量的碳和氫來進行調整。例如,添加一個氮原子需要移除一個CH2;添加一個氧原子需要移除一個CH4。
同位素效應[編輯]
譜圖中的同位素峰有助於結構解析。含有鹵素(尤其是氯和溴)的化合物會產生非常明顯的同位素峰。溴甲烷的質譜在m/z 94 (M) 和 96 (M+2) 處有兩個豐度相等的突出峰,在79和81處又有兩個屬於溴片段的峰。
即使化合物僅包含同位素峰豐度較低的元素(碳或氧),也可以將這些峰的分布和正確的化合物對應起來。例如,同為150 Da質量的化合物C8H12N3+和C9H10O2+可根據它們不同的M+2豐度來區分。
裂解[編輯]
除了確定未知化合物的莫耳質量外,電譜的裂解模式也適合提供結構信息,尤其是可以結合分子式(若適用)對不飽和度進行計算。經常丟失的中性碎片有一氧化碳、乙烯、水、氨和硫化氫。裂解過程大致有如下幾種:
α - 裂解(α - cleavage)[編輯]
裂解來自於均裂過程。如圖所示,該裂解緣於自由基位點的未配對電子與另一鍵的電子配對到電荷位點相鄰原子的趨勢[7]。該反應被定義為均裂,因為只有一個電子被轉移。這種反應的驅動力是自由基位點的給電子能力:N > S、O、π > Cl、Br > H[11],例如雜原子旁碳-碳鍵的斷裂。示意圖中的單電子運動由單向箭頭指示。

σ鍵斷裂[編輯]
烷烴的游離削弱了碳-碳鍵,導致了最終的分解[7]。化學鍵斷裂會產生帶電的偶數電子組分 (R+) 和中性自由基組分 (R•)。高度取代的碳正離子比未取代的更穩定。

誘導裂解(Inductive cleavage)[編輯]
如圖所示,該反應由自由基位點的誘導作用引起。由於轉移了一對電子,因此該反應被定義為異裂(heterolytic cleavage)。 [11]該反應的驅動力是自由基位點的電負度:鹵素 > O、S >> N、C,不如自由基位點反應來得常見。 [11]

麥克拉弗蒂重排[編輯]
麥克拉弗蒂重排反應(麥氏重排)發生在含有酮基的分子中,涉及 β-裂解,還伴隨著 γ-氫原子的獲得[12][13][14]。離子中性錯合物(ion-neutral complex)的形成涉及鍵均裂或鍵異裂,因為其中的動能不足以分離碎片,所以相互的反應類似於離子-分子反應。
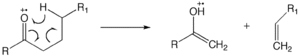
氫重排成飽和雜原子[編輯]
「1,5」氫位移導致一個γ-氫轉移到飽和雜原子上的自由基位點。麥氏重排的相同要求適用於氫重排為飽和雜原子。這種重排引發電荷位點反應,導致形成奇電子離子和小中性分子(水或酸等)。對於醇類,這種異裂會釋放一個水分子。由於電荷點反應在體積較小的醇中占主導地位,因此利於該反應的醇類排序如下:一級醇>二級醇>三級醇。 [11]
雙氫重排[編輯]
「1,5」氫位移導致兩個γ-氫轉移到兩個不一樣的不飽和原子上的兩個自由基位點。 麥氏重排的相同要求適用於雙氫重排。對於三個不飽和官能基,即硫酯、酯和醯胺,觀察到該反應。 [15]
正交重排(ortho rearrangement)[編輯]
「1,5」氫位移的相同要求發生在芳環鄰位的適當取代基之間。除了較強的 α,β 碳-碳雙鍵外,麥氏重排的相同要求適用於正交重排。這種重排引發電荷位點反應,導致形成奇電子離子和小中性分子(水或 HCl 等)。該反應可用於區分鄰位異構物與對位異構物和間位異構物。該反應也可見於三個不飽和官能基,即硫酯、酯和醯胺。 [11]

逆狄爾斯-阿爾德反應[編輯]
該反應主要發生在環己烯及其衍生物中。游離後,π 電子被激發並產生電荷位點和自由基位點,然後兩個連續的 α 裂解產生一個丁二烯自由基和一個中性乙烯,因為乙烯比丁二烯具有更高的游離能(史蒂文森規則)。 [11]

裂環反應(Cycloreversion reaction)[編輯]
該反應主要發生在四元環狀分子中。一旦被游離,它會產生一個非張力離子,然後進一步分裂以產生一個乙烯自由基離子和一個中性乙烯分子。 [11]
特定化合物類別的裂解模式[編輯]
烷烴[編輯]
對於直鏈烷烴,經常觀察到分子離子峰。然而,對於長鏈化合物,分子離子峰的豐度往往較低,線性片段通常相差 14 Da (CH2 = 14),例如己烷裂解模式:m/z=57 丁基陽離子是基峰,游離譜中其他豐度最高的峰是 m/z=15、29、43 Da 處的烷基碳陽離子。 [6][2][11]

支鏈烷烴在游離譜中具有豐度稍低的分子離子峰。它們傾向於在分支點斷裂。對於 2,3-二甲基丁烷,異丙基陽離子峰 (m/z=43) 豐度非常高。 [6][2][11]

環烷烴具有相對豐度較高的分子離子峰(兩個鍵必須斷裂)。烯烴裂解峰通常是最重要的模式。CH2CH 2 (= 28) 的丟失很常見(如果存在)。然而對於取代的環烷烴,它們更傾向於通過在支化點裂解形成環烷基陽離子。 [11]

烯烴[編輯]
由於 π 電子的游離能低於 σ 電子,因此烯烴通常會產生比烷烴豐度更高的分子離子峰。游離後,雙鍵很容易遷移,導致幾乎不可能測定異構物。由於共振穩定,烯丙基裂解是最重要的裂解模式。 [11]

麥氏重排是可能的(類似於羰基 π 鍵)。同樣,化學鍵遷移(bond migration)是可能的。 [11]

環己烯經常發生逆狄爾斯-阿爾德反應。
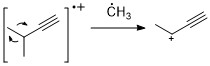
炔烴[編輯]
與烯烴類似,炔烴也常表現出豐度較高的分子離子峰。 Propargylic裂解是最重要的裂解模式。 [11]
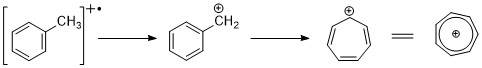
芳烴[編輯]
芳烴顯示出明顯的分子離子峰。苯甲基裂解很常見。當烷基連接到環上時,常見的裂解模式是失去一個 H 基以形成䓬 (m/z 91)。 [2][11]
烷基取代的苯可以由動力學主導的過程裂解形成 C6H5+ 、C6H6+離子。 [11]

另一種常見的斷裂模式是麥氏重排,它要求烷基鏈長度至少長於 3 個碳。 [11]

醇類[編輯]
由於氧的強電負度,醇類一般具有豐度較低的分子離子峰。由於共振穩定,α-解理很常見,最大的烷基將被丟掉。 [2]

另一種常見的裂解模式是脫水 (M-18)。對於更長鏈的醇,麥氏重排反應可以產生水和乙烯 (M-46)。
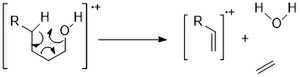
環狀醇傾向於顯示比線性鏈豐度更高的 M+ 峰。它們遵循類似的裂解途徑:α 裂解和脫水。 [11]
苯酚[編輯]
苯酚常常表現出豐度很高的分子離子峰。H· (M – 1)、CO (M – 28) 和甲醯基 (HCO·, M – 29) 常常被觀測到。 [2][11]

醚[編輯]
與相應的醇或烷烴相比,醚會產生豐度略高的分子離子峰。醚有以下兩種常見的解理模式:α-裂解和 CO 鍵裂解。

芳香醚通過失去烷基而不是 H 來生成 C6H5O+ 離子;這可以讓酚類在降解過程中丟掉 CO。 [11]

羰基化合物[編輯]
羰基化合物有五種類型,包括醛、酮、羧酸和酯。[2]主要的裂解模式描述如下:
由於氧孤對可以穩定正電荷,因此羰基官能基的任一側都可以發生 α 裂解。

由於共振穩定,β-裂解是羰基化合物斷裂的特徵模式。
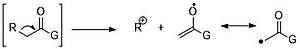
對於較長鏈的羰基化合物(碳數大於 4),麥氏重排占主導地位。

根據這些裂解模式,羰基化合物的特徵峰總結在下表中:
| 觀測到的離子 m/z | ||||||
| 裂解 | 路徑 | 醛類
G=H |
酮類
G=CH3 |
酯類
G=OCH 3 |
酸
G = O |
醯胺
G = NH2 |
| α-裂解 | R基團的損失 | 29 | 43 | 59 | 45 | 44 |
| α-裂解 | G自由基的丟失 | M-1 | M-15 | M-59 | M-45 | M-44 |
| β-裂解 | M-43 | M-57 | M-73 | M-59 | M-58 | |
| 麥氏重排 | 44 | 58 | 74 | 60 | 59 | |
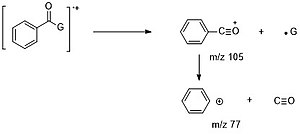
對於芳香族羰基化合物,常見的α-裂解途徑是先失去 G·(M – 1,15, 29...)以形成 C6H5CO+ 離子(m/z=105);進一步則是失去 CO(m/z=77)和 HCCH (m/z=51)。 [6]
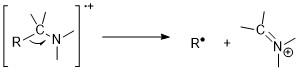
胺類[編輯]
胺類遵循氮規則,奇數的分子離子質荷比表明存在奇數個氮。儘管如此,脂肪胺中的分子離子峰的豐度很低,因為在胺旁邊很容易發生裂解。 α-裂解反應是胺最重要的裂解模式;對於 1° 正脂肪胺,在 m/z 30 處有一個高豐度的峰。 [11][6]
芳香胺具有豐度較高的分子離子峰。對於苯胺,它們更傾向於在丟掉 HCN 之前先失去一個氫原子。

腈類[編輯]
主要的裂解模式是由於共振穩定而從 CN 基團旁邊的碳中丟失一個 H 原子 (M – 1)。當它們的鏈更長時可能會出現麥氏重排。 [6]

硝基化合物[編輯]
脂肪族硝基化合物通常顯示出豐度較低的分子離子峰,而芳香族硝基化合物則顯示出豐度較高的峰。常見的裂解模式是損失NO+和NO2+ 。 [6]

電噴霧游離和大氣壓化學游離[編輯]
電噴霧游離和大氣壓化學游離由於游離機制不同,對質譜解釋的規則也不同。 [16]
相關條目[編輯]
參考資料[編輯]
- ^ Terrence A. Lee. A Beginner's Guide to Mass Spectral Interpretation. John Wiley & Sons. 4 February 1998 [2021-12-10]. ISBN 978-0-471-97629-5. (原始內容存檔於2017-03-16).
- ^ 2.0 2.1 2.2 2.3 2.4 2.5 2.6 Fred W. McLafferty. Interpretation of Mass Spectra. University Science Books. 1 January 1993 [2021-12-10]. ISBN 978-0-935702-25-5. (原始內容存檔於2017-03-16).
- ^ Spectrometric identification of organic compounds Silverstein, Bassler, Morrill 4th Ed.
- ^ Organic spectroscopy William Kemp 2nd Ed. ISBN 0-333-42171-X
- ^ 國際純化學和應用化學聯合會,化學術語概略,第二版。(金皮書)(1997)。在線校正版: (2006–) "electron ionization"。doi:10.1351/goldbook.E01999
- ^ 6.0 6.1 6.2 6.3 6.4 6.5 6.6 6.7 Pavia, Donald L. Introduction to spectroscopy. 2015: 141. ISBN 1-285-46012-X.
- ^ 7.0 7.1 7.2 Tureček, František; McLafferty, Fred W. Interpretation of mass spectra. Sausalito, Calif: University Science Books. 1993: 37–38. ISBN 0-935702-25-3.
- ^ David O. Sparkman. Mass Spectrometry Desk Reference. Pittsburgh: Global View Pub. 2007: 64. ISBN 0-9660813-9-0.
- ^ Karni, Miriam; Mandelbaum, Asher. The ‘even-electron rule’. Organic Mass Spectrometry. 1980, 15 (2): 53–64. ISSN 0030-493X. doi:10.1002/oms.1210150202.
- ^ Bright, J. W.; Chen, E. C. M. Mass spectral interpretation using the "rule of '13'". Journal of Chemical Education. 1983, 60 (7): 557. Bibcode:1983JChEd..60..557B. ISSN 0021-9584. doi:10.1021/ed060p557.
- ^ 11.00 11.01 11.02 11.03 11.04 11.05 11.06 11.07 11.08 11.09 11.10 11.11 11.12 11.13 11.14 11.15 11.16 11.17 11.18 11.19 Dass, Chhabil. Fundamentals of contemporary mass spectrometry. Wiley-interscience. 2007: 219–232. ISBN 978-0-471-68229-5.
- ^ F. W. McLafferty. Mass Spectrometric Analysis. Molecular Rearrangements. Anal. Chem. 1959, 31 (1): 82–87. doi:10.1021/ac60145a015.
- ^ Gross ML. Focus in honor of Fred McLafferty, 2003 Distinguished Contribution awardee, for the discovery of the "McLafferty Rearrangement". J. Am. Soc. Mass Spectrom. 2004, 15 (7): 951–5. PMID 15234352. doi:10.1016/j.jasms.2004.05.009.
- ^ Nibbering NM. The McLafferty rearrangement: a personal recollection. J. Am. Soc. Mass Spectrom. 2004, 15 (7): 956–8. PMID 15234353. doi:10.1016/j.jasms.2004.04.025.
- ^ Kingston, David G. Intramolecular hydrogen transfer in mass spectra. II. The McLafferty rearrangement and related reactions.. Chemical Reviews. 1974, 74: 216–242. doi:10.1021/cr60288a004.
- ^ Holčapek, Michal; Jirásko, Robert; Lísa, Miroslav. Basic rules for the interpretation of atmospheric pressure ionization mass spectra of small molecules. Journal of Chromatography A. 2010, 1217 (25): 3908–3921. ISSN 0021-9673. PMID 20303090. doi:10.1016/j.chroma.2010.02.049.






